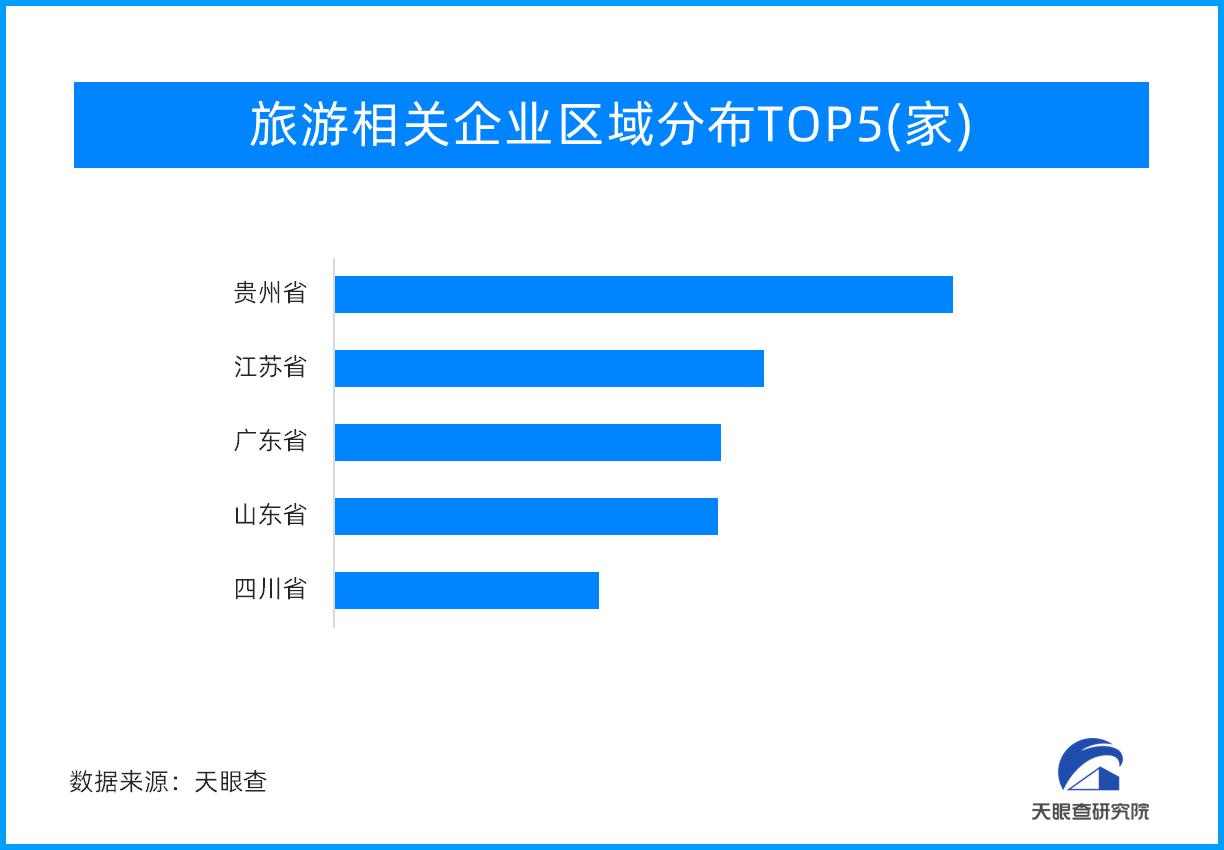
定制式医疗器械将备案管理
发布时间:2019-07-07 12:38来源: 网络阅读量:18360
7月4日,国家药监局、国家卫生健康委联合发布《定制式医疗器械监督管理规定(试行)》,明确定制式医疗器械仅供提出特殊需求出具订单的医疗机构用于指定患者,非订单机构或者非指定患者不得使用。对定制式医疗器械实行备案管理,医疗器械生产企业及医疗机构共同作为定制式医疗器械备案人。《规定》将于2020年1月1日起施行。
定制式医疗器械,是指针对指定患者罕见特殊病损的治疗,在我国已上市产品难以满足临床需求的情况下,由医疗器械生产企业基于医疗机构特殊临床需求设计和生产,用于指定患者的、预期能提高诊疗效果的个性化医疗器械。
《规定》在定制式医疗器械备案管理、设计加工、使用管理、监督管理等方面做出了明确要求。根据要求,当定制式医疗器械临床使用病例数及前期研究能够达到上市前审批要求时,生产企业应按照规定,申报注册或办理备案;符合伦理准则且真实、准确、完整、可溯源的临床使用数据,可作为临床评价资料用于注册申报。(记者刘志勇)
声明:本网转发此文章,旨在为读者提供更多信息资讯,所涉内容不构成投资、消费建议。文章事实如有疑问,请与有关方核实,文章观点非本网观点,仅供读者参考。